Temperatur
Temperatur ist ein grundlegender Begriff in der Physik und spielt eine wichtige Rolle in verschiedenen Bereichen der Naturwissenschaften. Im thermodynamischen Gleichgewicht kann sie als eine Intensitätsgröße definiert werden (jeder Teil eines Körpers hat die gleiche Temperatur). Sie definiert eine Ordnungsrelation: Körper höherer Temperatur geben Wärme an Körper tieferer Temperatur ab; Körper gleicher Temperatur tauschen keine Wärme aus.
Die Temperatur beeinflusst viele physikalische Eigenschaften von Stoffen. Zum Beispiel dehnen sich die meisten Materialien bei Erwärmung aus und ziehen sich bei Abkühlung zusammen. Dieses Phänomen wird als thermische Ausdehnung bezeichnet und ist wichtig für die Konstruktion von Gebäuden, Brücken und anderen Strukturen.
In unseren Artikeln haben wir verschiedene Aspekte der Temperatur behandelt, wie zum Beispiel die Anwendung des zweiten Hauptsatzes der Thermodynamikzweiten Hauptsatzes der Thermodynamik auf den Temperaturausgleich, die Veranschaulichung der freien Energie bei einer isochoren Zustandsänderung im TS-Diagramm und die Berechnung der Entropie des idealen einatomigen Gases.
Aufgabe der statistischen Mechanik ist es dann, die Eigenschaften der Temperatur aus der Thermodynamik mikroskopisch zu erkläreneine entscheidende Rolle. Dazu wird angenommen, dass alle Mikrozustände mit gleicher Wahrscheinlichkeit auftreten. Der Gleichgewichtszustand ist dann derjenige Zustand, der durch die größte Anzahl an Mikrozuständen realisiert werden kann. Dies führt zur Definition der Boltzmann-Entropie, die eng mit der Temperatur verknüpft ist.
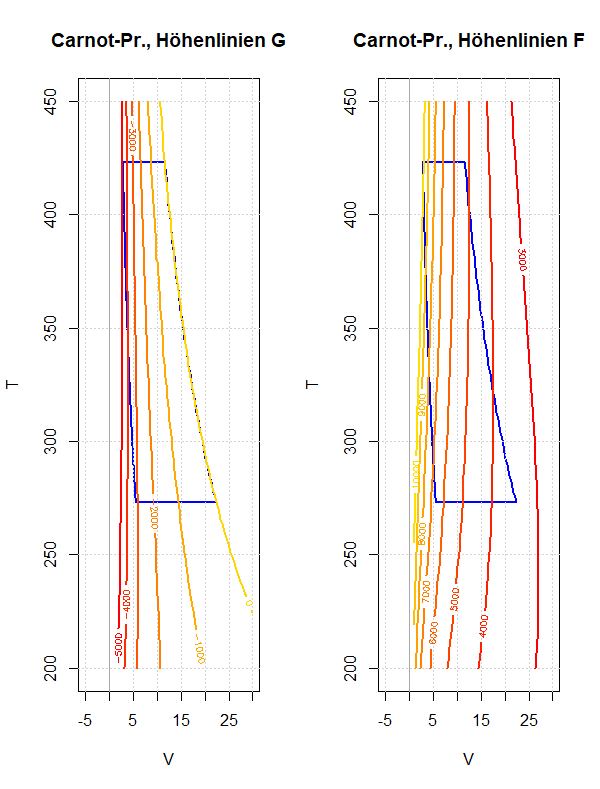
Am Beispiel des Carnot-Prozesses soll das Verhalten der freien und der gebundenen Energie während eines Umlaufs diskutiert werden. Dies soll die Bedeutung dieser thermodynamischen Potentiale besser verständlich machen; speziell ob und wie sie als Arbeitsfähigkeit beziehungsweise Wärmeinhalt eines Systems interpretiert werden können.
Am Beispiel der isochoren Erwärmung werden die Eigenschaften der freien Energie F = U - TS und der gebundenen Energie G = TS erläutert. Speziell wird gezeigt, wie man ihre Veränderung darstellen kann, wenn man vom US-Diagramm zum TS-Diagramm übergeht.
Die freie Energie F = U - TS ist die (negative) Legendre-Transformierte der inneren Energie U, wenn diese als Funktion der extensiven Variablen Entropie S und Volumen V dargestellt wird: U = U(S, V); die Legendre-Transformation wird dabei bezüglich der Variable S berechnet. Es ist dann leicht nachzuweisen, dass die freie Energie ein thermodynamisches Potential ist und dass die Änderung der freien Energie bei isothermen Zustandsänderungen mit der Zufuhr von mechanischer Arbeit übereinstimmt.
Mit Hilfe der freien Energie und der gebundenen Energie soll die innere Energie in zwei Anteile zerlegt werden: Die freie Energie soll allein durch die Zufuhr von mechanischer Arbeit und die gebundene Energie allein durch die Zufuhr von Wärme verändert werden. Diese Zerlegung lässt sich allerdings nur für isotherme Prozesse durchführen. Die Eigenschaften der freien und gebundenen Energie werden für die isotherme Zustandsänderung und andere einfache Prozesse diskutiert.
Mit dem Druckausgleich (also zwei Kammern mit einer beweglichen Trennwand, in der sich anfangs Gase mit unterschiedlichem Druck befinden) lassen sich zahlreiche Aspekte der Entropie und allgemeiner der Thermodynamik demonstrieren (reversible und irreversible Prozessführung, Eindeutigkeit des Endzustandes, Maximum der Entropie, Temperatur- und Volumenabhängigkeit der Entropie).
Wird die innere Energie als Funktion der extensiven Variablen dargestellt, enthält sie sämtliche Eigenschaften des entsprechenden thermodynamischen Systems; dies rechtfertigt die innere Energie als thermodynamisches Potential zu bezeichnen. Untersucht man speziell die innere Energie bei adiabatischen Zustandsänderungen, so kann man leicht motivieren, weshalb andere thermodynamische Potentiale (wie freie Energie oder Enthalpie) eingeführt werden. Am idealen einatomigen Gas werden diese Eigenschaften der inneren Energie demonstriert.
Der Carnot-Prozess ist sowohl inhaltlich als auch methodisch wichtig für die Thermodynamik: Seine Analyse liefert zahlreiche Einsichten in ihre Konzepte, Argumentationsweisen und technische Anwendungen.
Für das ideale einatomige Gas werden die Zusammenhänge zwischen den Hauptsätzen der Thermodynamik und den Zustandsgleichungen (thermische und kalorische Zustandsgleichung) diskutiert und angewendet, um die Entropie in verschiedenen Darstellungen zu berechnen. Illustriert werden die Herleitungen an speziellen Zustandsänderungen (isotherm, isochor, adiabatisch, freie Expansion).
Es werden Simulationen zum Temperaturausgleich durchgeführt: Das Modellsystem mit äquidistanten Energieniveaus wird in zwei Teilsysteme zerlegt, die anfangs unterschiedliche Energie haben. Es entwickelt sich unter einer einfachen Dynamik, bei der zufällig zwei Moleküle ausgewählt werden, die ein Energiequant austauschen.
Die Ergebnisse der Simulationen sollen die Konzepte illustrieren, mit denen die statistische Mechanik einen irreversiblen Vorgang beschreibt, der in der phänomenologischen Thermodynamik als Paradebeispiel für den zweiten Hauptsatz dient.
Das Modellsystem mit äquidistanten Energieniveaus wird mit einer einfachen Dynamik ausgestattet, die es erlaubt Energie zwischen zwei Molekülen auszutauschen. Damit lässt sich beobachten, welche Folge von Zuständen das System einnimmt, wenn man es in einem unwahrscheinlichen Mikrozustand startet. Die vorgestellten Simulationen und ihre Auswertung liefern weitere Illustrationen der Konzepte der statistischen Mechanik: Mikro- und Makrozustände, statistische Interpretation des zweiten Hauptsatzes der Thermodynamik.
In den vorausgegangenen Kapiteln wurden die Abzählprobleme behandelt, die sich ergeben, wenn ein thermodynamisches System entweder auf der Ebene der Mikrozustände oder der Makrozustände beschrieben wird. Vergleicht man diese Ergebnisse mit den Gleichungen der phänomenologischen Thermodynamik, kann man eine statistische Definition der Entropie ableiten und damit eine (statistische) Erklärung des zweiten Hauptsatzes der Thermodynamik liefern. Die Boltzmann-Entropie wird mit Hilfe der Anzahl der Mikrozustände pro Makrozustand definiert und besitzt die Eigenschaften, die man innerhalb der Thermodynamik an die Entropie stellt.
Es werden zwei Anwendungen des Entropiesatzes besprochen. Zum Einen warum Wärme immer vom wärmeren zum kälteren Körper strömt und niemals umgekehrt. Zum Anderen die Entropieproduktion bei einem Mischvorgang. Dabei wird geklärt, für welchen Rechenschritt welcher Hauptsatz der Thermodynamik verwendet wird.